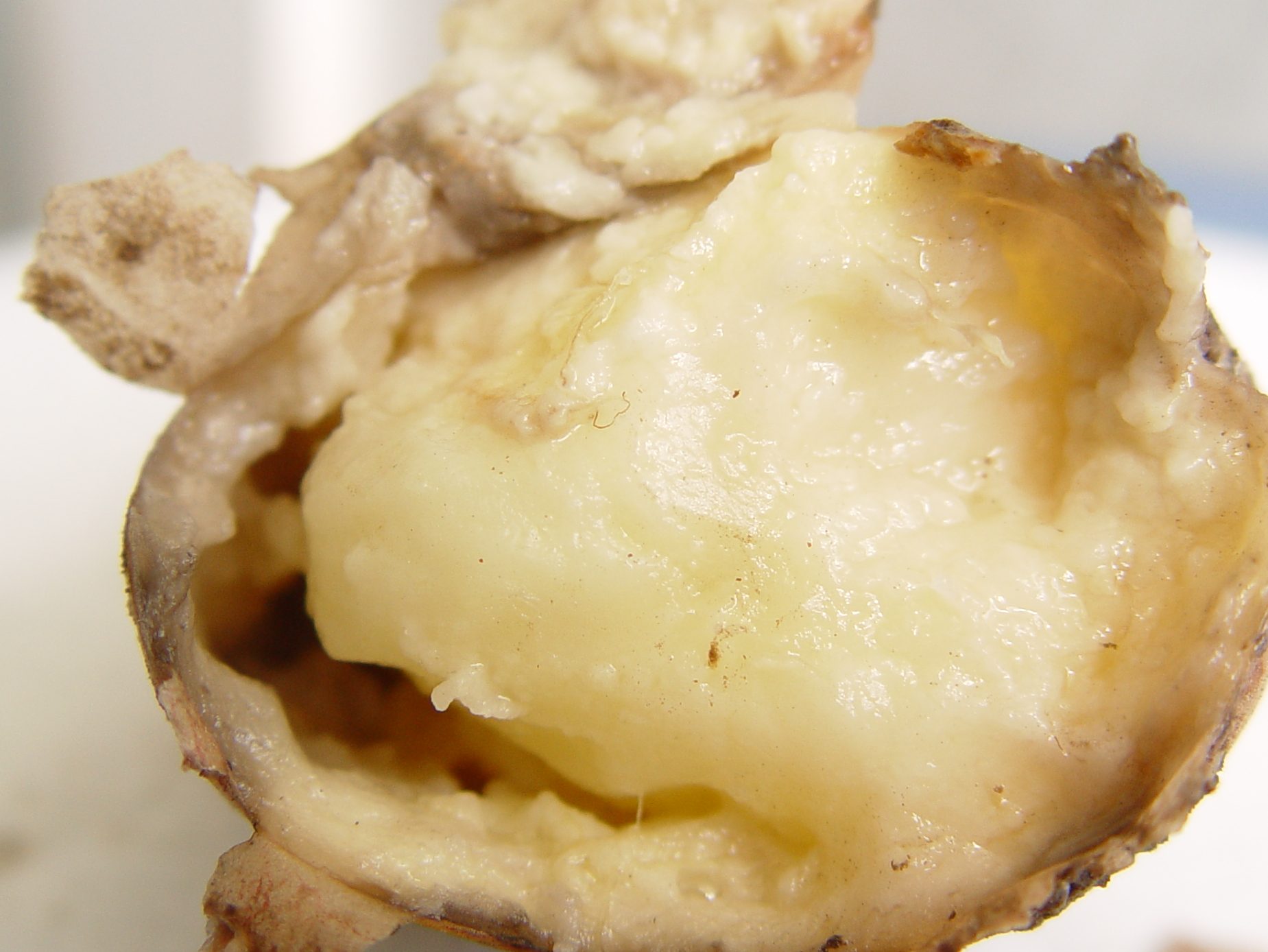
Бактериальные заболевания – мокрая гниль и чёрная ножка – часто являются причиной самых серьёзных потерь при производстве и хранении картофеля. Возбудителями этих заболеваний являются бактерии, принадлежащие к родам Pectobacterium и Dickeya, ранее известным как Erwinia.
Разные виды Pectobacterium и Dickeya могут вызывать как мокрую гниль, так и чёрную ножку. Однако, мокрую гниль клубней во время хранения, как правило, вызывает Pectobacterium carotovorum subsp. carotovorum – бактерия, которая практически всегда присутствует на поверхности клубня, в чечевичках и в механических повреждениях клубней. Эта бактерия не является специфическим патогеном картофеля и вызывает мокрую гниль у широкого спектра видов и сортов растений. По этой причине выращивание семенного картофеля на участках, на которых картофель не культивировали в течение длительного времени, не является гарантией отсутствия возбудителей мокрой гнили.
Повреждение ботвы картофеля, проявляющееся в виде увядания, чёрной ножки или стеблевой гнили, вызывают разные виды Pectobacterium и Dickeya. В настоящее время на территории Российской Федерации наиболее актуальными патогенами из этой группы являются P. atrosepticum (классическая чёрная ножка), P. parmentieri (ранее P. wasabiae), P. odoriferum и P. carotovorum subsp. brasiliensis. Один из самых агрессивных видов – D. solani, который до недавнего времени был основной причиной развития чёрной ножки и стеблевой гнили картофеля, в сезоне 2017 г. пратктически не встречался (скачать презентацию в формате PDF).
Возникновение и развитие заболеваний мокрая гниль и чёрная ножка картофеля определяется условиями окружающей среды, в первую очередь, влажностью и температурой. Бактериозы наиболее вероятны в сезоны с высокой влажностью. Использование заражённого семенного картофеля существенно повышает риск потерь на ранних стадиях культивирования – возможно гниение материнских клубней в почве и развитие чёрной ножки на ботве. При закладке на хранение урожая, убранного из влажной почвы, значительно повышается риск развития мокрой гнили клубней в хранилище.
Отдельной проблемой может быть орошение полей водой из источников, содержащих патогенные бактерии.
Таким образом, в зависимости от целей, для оценки риска возникновения и развития мокрой гнили и чёрной ножки рекомендуется тестировать клубни на наличие возбудителей семенного картофеля как перед высадкой в поле так и перед закладкой собранных клубней на хранение.
Диагностика возбудителей мокрой гнили и чёрной ножки картофеля
Испытательная лаборатория ООО “Независимая диагностическая лаборатория” оказывает услуги по диагностике семенного картофеля на наличие возбудителей чёрной ножки и мокрой гнили с учётом требований соответствующего ГОСТ.
Требования ГОСТ
Уровень заражения семенного картофеля возбудителями мокрой гнили и чёрной ножки, а также методы отбора проб и определения качества семенного картофеля регламентируются ГОСТ 33996-2016 “Картофель семенной. Технические условия и методы определения качества”:
- наличие растений с проявлением внешних признаков чёрной ножки в исходном материале, оригинальном и элитном семенном картофеле не допускается (пункт 5.1.2; таблица 1)
- в репродукционном семенном картофеле допускается наличие клубней с проявлением внешних признаков чёрной ножки (в процентах по счёту) не более 1% (пункт 5.1.2; таблица 1)
- наличие клубней с проявлением внешних признаков мокрой гнили в исходном материале и оригинальном семенном картофеле не допускается (пункт 5.1.2; таблица 1)
- в элитном и репродукционном семенном картофеле допускается наличие клубней с проявлением внешних признаков мокрой гнили (в процентах по счёту) не более 1% (пункт 5.1.2; таблица 1)
- по результатам лабораторного тестирования в исходном материале и оригинальном семенном картофеле наличие бактериальной инфекции, вызванной Dickeya spp и Pectobacterium spp., не допускается (пункт 5.1.11; таблица 2)
- для партий суперэлитного, элитного и репродукционного семенного картофеля лабораторное тестирование проводится по заявке производителя или поставщика семенного картофеля. Предельно допустимые нормы ограничения бактериальной инфекции по результатам лабораторного тестирования клубневых проб могут устанавливаться в договорах (контрактах) на поставку семенного картофеля по договоренности сторон (пункт 5.1.11; таблица 2)
- клубневой анализ проводят на объединённой пробе, собранной из точечных проб, объёмом не менее 250 клубней (пункт 6.4.3)
- чёрную ножку определяют по внешним симптомам её проявления на растениях, подземной части стеблей и образовавшихся клубнях (пункт 7.1.3)
- для определения наличия клубней с внутренним поражением мокрой гнилью и чёрной ножкой из объединенной пробы из разных мест отбирают 100 клубней. Клубни разрезают ножом вдоль продольной оси через столон и осматривают мякоть клубня на разрезе. Клубни, пораженные мокрой гнилью и чёрной ножкой, считают больными при любой степени проявления симптомов (пункт 7.2.8)
- для проведения лабораторного тестирования на заражённость бактериальной инфекцией отбирают 200 клубней для оригинального семенного картофеля и 100 клубней для элитного семенного картофеля (пункт 6.3.1; таблица 6)
- полимеразная цепная реакция (ПЦР) и иммуноферментный анализ (ИФА) являются методами лабораторного тестирования исходного материала, оригинального и элитного семенного картофеля (пункты 5.1.11, 7.3.1, 7.3.2).
Чёрная ножка картофеля. Методы диагностики
Ключевым фактором развития мокрой гнили и чёрной ножки, помимо факторов окружающей среды, является степень инфицирования клубней пектолитическими бактериями. По этой причине целью тестирования семенного картофеля на наличие возбудителей этих заболеваний является не столько факт установления их наличия в образце, сколько определение количества вирулентных бактерий на условную единицу, например, грамм веса кожуры.
Лабораторная диагностика позволяет оценить риск возникновения и развития заболеваний, поскольку при появлении благоприятных для бактерий условий, вероятность бактериозов будет существенно выше в случае использования семенного материала с более высоким уровнем заражения пектолитическими бактериями. Критическим считается показатель 10 миллионов бактерий на грамм веса кожуры. При таком уровне заражения начинается необратимое разрушение растительной ткани.
Для получения объективных данных об уровне заражения клубней картофеля возбудителями мокрой гнили и чёрной ножки в Независимой диагностической лаборатории применяется комплексный подход, сочетающий в себе микробиологическое определение количества вирулентных пектолитических бактерий в образце посредством культивирования бактерий на полуселективной питательной среде и молекулярно-биологическую оценку видового разнообразия выявленных патогенов методом полимеразной цепной реакции (ПЦР).
Тестирование материала картофеля на наличие возбудителей мокрой гнили и чёрной ножки
| Тест | Объём образца | Исследуемый организм | Метод тестирования | Результат теста | Сроки проведения теста |
|---|---|---|---|---|---|
| Базовый анализ возбудителей мокрой гнили и чёрной ножки (в т.ч. в скрытой форме) | 110 клубней | Pectobacterium atrosepticum, прочие виды рода Pectobacterium, виды рода Dickeya | Тест проводится на 3-х объединённых пробах объёмом 33-34 клубня. Культивирование бактерий на полуселективной питательной среде, ПЦР в режиме реального времени с зондами Taqman | Общее количество вирулентных пектолитических бактерий, пересчитанных на грамм кожуры, присутствие/отсутствие анализируемых групп бактерий и, при наличии, их соотношении в образце | до 5 дней |
| Полный анализ возбудителей мокрой гнили и чёрной ножки (в т.ч. в скрытой форме) | 110 клубней | Pectobacterium atrosepticum, P. carotovorum subsp. brasiliensis, P. carotovorum subsp. carotovorum, P. parmentieri, P. odoriferum, виды рода Dickeya | Тест проводится на 3-х объединённых пробах объёмом 33-34 клубня. Культивирование бактерий на полуселективной питательной среде, ПЦР в режиме реального времени с зондами Taqman и с электрофоретическим разделением фрагментов ДНК | Общее количество вирулентных пектолитических бактерий, пересчитанных на грамм кожуры, присутствие/отсутствие анализируемых групп бактерий и, при наличии, их соотношении в образце | до 5 дней |
| Усреднённая оценка общего заражения образца возбудителями мокрой гнили и чёрной ножки (в т.ч. в скрытой форме) | 110 клубней | Вирулентные пектолитические бактерии без определения родовой и видовой принадлежности | Тест проводится на 3-х объединённых пробах объёмом 33-34 клубня. Культивирование бактерий на полуселективной питательной среде | Общее количество вирулентных пектолитических бактерий, пересчитанных на грамм кожуры | до 5 дней |
| Определения степени заражения образца возбудителями мокрой гнили и чёрной ножки (в т.ч. в скрытой форме) | 110 клубней | Вирулентные пектолитические бактерии без определения родовой и видовой принадлежности | Тест проводится на 25 объединённых пробах объёмом 4 клубня. Культивирование бактерий на полуселективной питательной среде | Степень заражения образца возбудителями мокрой гнили и чёрной ножки (в процентах от общего количества исследованных клубней) | до 5 дней |
| Определения степени заражения образца возбудителями мокрой гнили и чёрной ножки | 110-260 клубней | Пектолитические бактерии без определения родовой и видовой принадлежности | Визуальное выявление клубней с внешними и внутренними признаками поражения мокрой гнилью и чёрной ножкой Рекомендуется подтвердить результаты визуальных наблюдений постановкой ПЦР | Степень заражения образца возбудителями мокрой гнили и чёрной ножки (в процентах от общего количества исследованных клубней) | до 2-х дней |
| Определение возбудителей мокрой гнили и чёрной ножки в клубнях и надземных частях растений с симптомами поражения | 1 образец | Pectobacterium atrosepticum, P. carotovorum subsp. brasiliensis, P. carotovorum subsp. carotovorum, P. parmentieri, P. odoriferum, Dickeya solani, D. dianthicola, прочие виды рода Dickeya | ПЦР в режиме реального времени с зондами Taqman и с электрофоретическим разделением фрагментов ДНК | Присутствие/отсутствие анализируемых групп бактерий в образце | до 3-х дней |