Диагностика вирусов и бактерий картофеля методом ИФА
Иммуноферментный анализ (ИФА, англ. enzyme-linked immunosorbent assay, ELISA) – лабораторный метод качественного и количественного определения разнообразных молекул, вирусов, бактерий и т.п. В основе метода лежит высокоспецифичная иммунологическая реакция антитела и антигена.
Антителами являются сложные белковые молекулы (иммуноглобулины), синтезируемые клетками иммунной системы человека и прочих теплокровных животных в ответ на проникновение в организм антигенов – вирусов, бактерий, молекул и прочих чужеродных объектов. Высокая специфичность взаимодействия между антителом и антигеном обусловлена тем, что активный центр антитела способен связываться с уникальным фрагментом антигена. Именно это свойство реакции антитело-антиген определяет специфичность, надёжность, достоверность и чувствительность ИФА при проведении диагностики патогенов картофеля. При наличии целевого патогена в исследуемом образце формируется комплекс соответствующих антител и антигена, детекцию которого определяют по активности фермента, связанного с антителами.
Существует широкое разнообразие методов проведения ИФА, различающихся природой антигена, принципом связывания, условиями проведения, способами детекции результатов ферментативной реакции и т.п. Для диагностики патогенов сельскохозяйственных культур традиционно используется “сэндвич”-метод с использованием двух типов антител (DAS-ELISA – double antibody sandwich enzyme-linked immunosorbent assay). В качестве фермента, обычно, используется щелочная фосфатаза.
Проведение иммуноферментного анализа
Реакция проводится в 96-луночных полистирольных микропланшетах, характеризующихся высокой эффективностью связывания белковых молекул, в т.ч. иммуноглобулинов (антител), на своей поверхности.
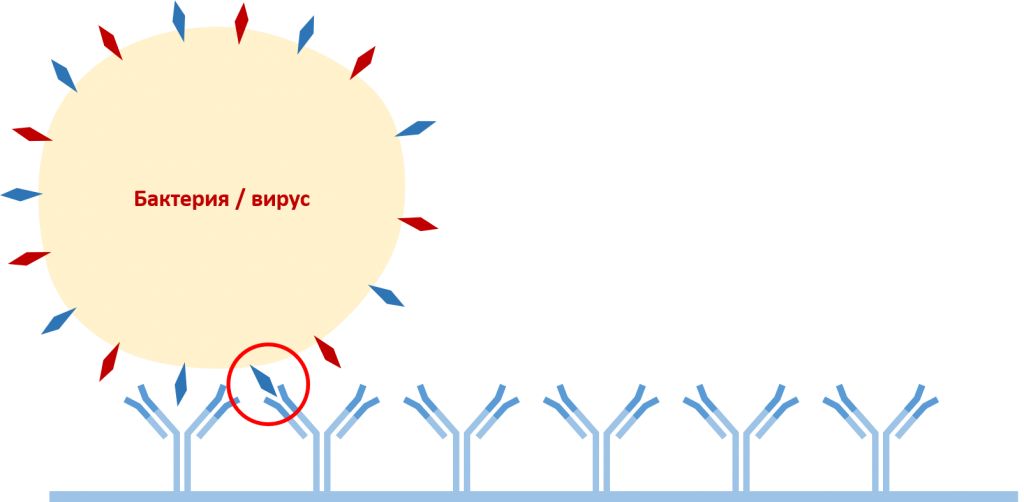
На первом этапе антитела захвата (capture antobodies) разводят в необходимой концентрации в покровном буфере (coating buffer), вносят в лунки микропланшетов и инкубируют от нескольких часов при температуре +30-37°С до нескольких дней при температуре +4°С. Во время инкубирования антитела неспецифически адсорбируются на поверхности лунок микропланшета. По окончании инкубирования планшеты промывают несколько раз промывочным буфером (wash buffer) для удаления антител захвата, которые не связались с поверхностью микропланшета.

На следующем этапе в лунки микропланшета, поверхность которых покрыта антителами захвата, вносят сок, экстракт, или гомогенат растений, исследуемых на наличие антигенов – патогенных бактерий или вирусов и инкубируют 14-16 часов при температуре +4°С. При необходимости, растительный материал можно развести экстракционным буфером (extraction buffer). По окончании инкубирования лунки несколько раз промывают промывочным буфером.
При наличии целевого патогена в образце происходит взаимодействие специфичного фрагмента антигена с соответствующим антигенсвязывающим центром антител захвата.
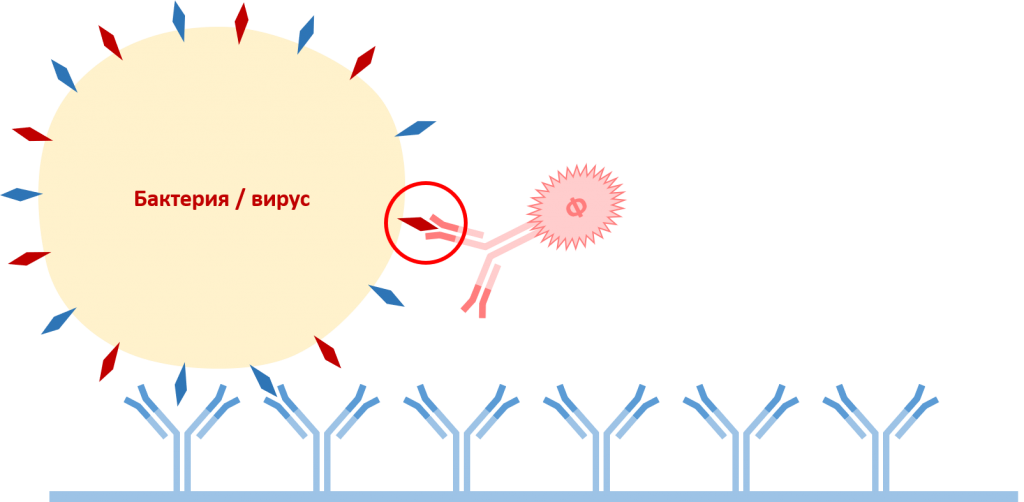
В промытые лунки наносят антитела детекции, конъюгированные с ферментом щелочная фосфатаза (Ф). Антитела разводят в необходимой концентрации в конъюгатном буфере (conugation buffer). Микропланшеты инкубируют при температуре +30°С в течение 5 часов. По окончании инкубирования микропланшеты несколько раз промывают промывочным буфером для удаления антител детекции, не связавшихся с антигенами.
На данном этапе происходит взаимодействие специфичного фрагмента антигена с соответствующим антиегнсвязывающим центром антител детекции. Антигенсвязывающие центры антител захвата и антител детекции различны и специфично связываются с разными фрагментами антигена.
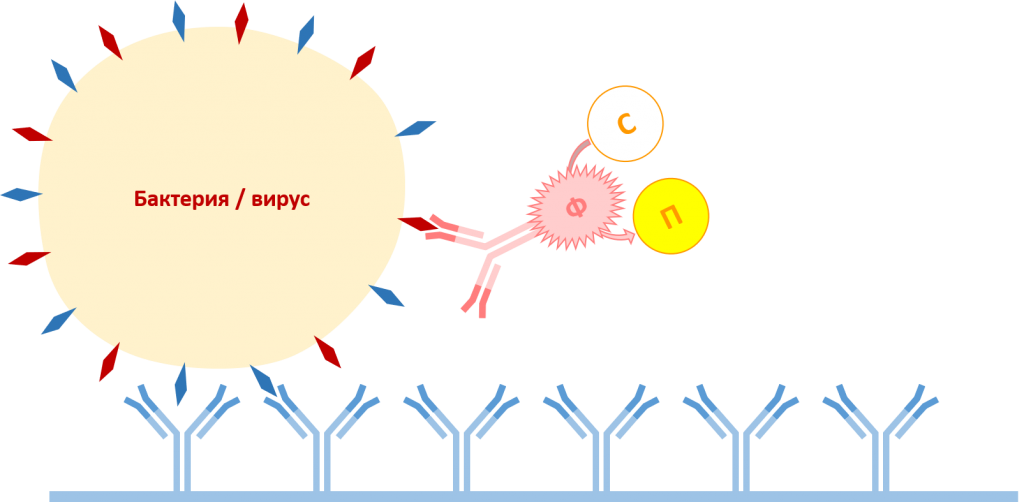
На заключительном этапе в лунки добавляют пара-нитрофенилфосфат, являющийся субстратом для фермента щелочная фосфатаза. При наличии в растительном образце целевых патогенов формируется комплекс антитело захвата-антиген (вирус или бактерия)-антитело детекции, конъюгированное с ферментом щелочная фосфатаза. Фермент (Ф) катализирует превращение бесцветного пара-нитрофенилфосфата (субстрат, С) в жёлтый пара-нитрофенол (продукт, П), в результате чего происходит окрашивание реакционной смеси в жёлтый цвет. Интенсивность окраски реакционной смеси можно оценивать как визуально, так и с помощью спектрофотометра.